Source: http://www.tulane.edu/~wiser/protozoology/notes/malaria.html
Маларија је био и још увек је узрок великог људског морбидитета и морталитета. Иако је болест искорењена у већини умереним зонама, она наставља да буде ендемска током већег дела тропским пределима и субтропа. Четрдесет одсто светске популације живи у ендемске области. Епидемије су девастирани велике популације и маларије представља озбиљну препреку за економски напредак у многим земљама у развоју. Процењује се да је 300-500 милиона случајева клиничке болести годишње са 1.5-2.7 милиона смртних случајева. Неки од најранијих познатих медицинских списа из Кине, Асирији и Индији тачно описати повремене грознице маларије налик. Хипократ, “отац медицине”, се обично приписује првом описом клиничких симптома код 500 пне, више од 2000 година пре паразита описана (табела). [Види такође Википедиа чланак о Хистори оф маларије.]
| Хисторицал Издвајамо | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
- Животни циклус
- Клиничке манифестације
- Патогенеза и церебралне маларије
- Епидемиологија и контрола
- Дијагноза
- Хемотерапија и дрога Отпор
Маларија узрокована чланови рода Пласмодиум. Пласмодиум врсте су Апицомплека (види општи опис Апицомплека) и показују хетерокеноус животни циклус укључује кичмењачког домаћина и један артроподних вектор. Кичмењака домаћини укључују: гмизаваца, птица, глодара, мајмуна и људи. Пласмодиум врсте су углавном домаћини специфичан и векторску специфичан по томе ће свака врста само инфицира ограничен избор домаћина и вектора. Четири различита врста инфицираних људи: П. фалципарум, П. вивак, П. овале и П. малариае. (Види страну на разликама врста.) Врсте се разликују у погледу њихове морфологије, детаље о својим животним циклусима, и њихових клиничких манифестација.
Животни циклус
Људских и других сисара Пласмодиум врсте се преносе анопхелине комарци. Паразит се убризгава са пљувачком током комараца храњења и први подвргава рунду мерогони у јетри затим вишеструким круга мерогони у еритроцитима. Гаметогони почиње унутар еритроцита у кичмењака домаћина и завршена у комарца где спорогони одвија. Овај животни циклус показује опште карактеристике других апицомплекан паразита карактерише асексуалног репликацију и формирање инвазивних фаза са типичним апексног органелама.
Јетра фаза. Хуман инфекција започиње када спорозоитес убризгавају са пљувачком током комараца храњења. У спорозоитес улазе у крвоток и унутар 30-60 минута покренути инвазију ћелију јетре. Хост улазак ћелија, као иу целој Апицомплека, олакшава апикалним органелама. Након инвазију хепатоцита, паразит пролази једног асексуалног репликацију. Овај репликативну фаза се често назива екоеритхроцитиц (или пре-еритроцитна) сцхизогони. Сцхизогони односи на репликативног процес у коме паразит пролази вишеструке рунде нуклеарног поделе без цитоплазматском поделе праћена пупољка или сегментацију, да се формира потомство. Потомство, називају мерозоита, се ослобађају у крвоток након руптуре хепатоцита домаћина. (Видети животног циклуса фигура.)
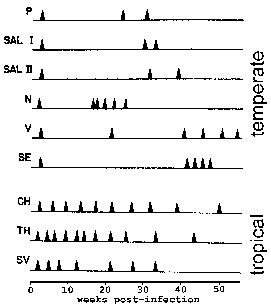
У П. вивак и П. овале неке спорозоитес не одмах подвргну асекуал репликацију, али унесите мировања фазу познат као хипнозоите. (Међутим, подигнути су нека од питања о томе да ли П. овале експоната у хипнозоите фази Погледајте Рицхтер ет ал, 2010, Паразитологија истраживања 107:.. 1285) Овај хипнозоите може поново активирати и подвргне сцхизогони касније доводи у рецидива. Релапсе има посебно значење у погледу маларије и односи реактивирања инфекције преко хипнозоитес. Поновно избијање се користи да опише ситуацију у којој паразитемије пада испод нивоа могу детектовати, а касније повећава до патента паразитемије. Занимљиво сојеви изоловани из умереним регионима испољавају дужу латентног периода између примарне инфекције и првог рецидива него сојева из тропског поднебља са континуираног преноса (слика).
Крв фаза. Мерозоита пуштен из инфицираних ћелија јетре инвазију еритроците. У мерозоита препознају специфичне протеине на површини еритроцита и активно нападају ћелију на начин сличан осталим апицомплекан паразита. (Погледајте детаље о механизму инвазије ћелија домаћина.) Након уношења еритроцита паразит пролази кроз тропску период праћен једног асексуалног репликације. Млади тропхозоите се често назива формулар прстен због своје морфологије у Геимса обојених крви размаза. Као паразитних повећањем величине ова ‘прстен’ морфологија нестаје и то се зове тропхозоите. Током трофичком периода паразит унесе цитоплазме ћелија домаћин и разграђује се хемоглобин у аминокиселина. А би-производ хемоглобина варења јесте маларије пигмент или хемозоин. (Видети напомене о вакуоли хране на Пласмодиум.) Ове златно-браон до црне грануле су одавно препознали као препознатљив обележје крви-сценских паразита.
Нуклеарна подела означава крај тропхозоите фази и почетак сцхизонт фази. Еритроцитна сцхизогонги чине 3-5 рунди (у зависности од врсте) нуклеарних репликације уследио Бадингова процесом. Касној фази сцхизонтс у којима су појединачни мерозоита постају назире се зове сегментерс. Тхе Хост еритхроците руптуре и јавност су мерозоита. Ове мерозоита инвазију нових еритроцита и покрене још једну рунду сцхизогони. Крвно-стаге паразити унутар домаћина обично пролазе кроз синхрони сцхизогони. Истовремено пуцање заражених еритроцита и пратећег ослобађање антигена и отпадних продуката рачуни за испрекиданим грознице пароксизама повезаних са маларијом. Крв стаге сцхизогони у П. фалципарум разликује од других људских маларијским паразитима у том тропхозоите- и сцхизонт-инфициране еритроцитима придржавају капиларних ендотелијалних ћелија и не налазе у периферној циркулацији. Ова заплена је повезана са церебралном маларије. (Видети животног циклуса фигура.)
Сексуално фаза. Као алтернатива сцхизогони неке паразита ће проћи сексуални циклус и терминално диференцира у било микро или мацрогаметоцитес. Фактори укључени у индукцији гаметоцитогенесис нису познати. Међутим, посвећеност сексуалном фази јавља током асексуалног еритроцитна циклуса који непосредно претходи гаметоците формације. Ћерка мерозоита овог сцхизонт ће се развити у било све асексуалних облицима или свих сексуалних облика. Гаметоцитес не изазивају патологије у људском организму и да ће нестати из оптицаја ако не заузимају комарац.
Гаметогенезе или формирање микро и мацрогаметес, је индукован када су гаметоцитес унесе комарац. Пошто га прогута комарца је мицрогаметоците пролази три рунде нуклеарне репликације. Ових осам језгра затим бити повезан са флагела који проистиче из тела мицрогаметоците. Овај процес је лако уочљива светлосним микроскопом због млаћење флагела и зове се екфлагеллатион. У мацрогаметоцитес сазревају у мацрогаметес. Међутим, на морфолошке нивоу то је много мање драматична него екфлагеллатион изложене од стране мицрогаметоцитес.
Екфлагеллатион настаје спонтано када Инфецтед крв је изложена ваздуху. Критични фактори укључени у индукцији ове гаметогенезе су смањење температуре, смањење у раствореног угљен-диоксида и накнадна повећање пХ на изнад 8,0 (Бок). Ова помало опонаша промене животне средине доживљавају стране гаметоцитес у томе да ће бити промјена до собне температуре и црева за комарца показује пХ око 7,8 у поређењу са пХ 7,4 за крв. Поред тога, комарац изведен екфлагеллатион фацтор (МЕФ) је такође описан и идентификовани као Ксантуренска Киселина, метаболита од инсеката. Ксантуренска Киселина снижава попустљив пХ за екфлагеллатион испод 8,0 и евентуално биолошки знак за паразита подвргне гаметогенезе (Биллкер и сарадници, Натуре 392: 289, 1998; Биллкер и сарадници, Целл 117: 503, 2004).
Гаметогенезу / Екфлагеллатион
јавља спонтано након излагања ваздуху
↓ температуре (2-3оЦ)
↓ pCO2
↑ pH (8-8.3)
Москуито-изведен Екфлагеллатион Фацтор смањује попустљив пХ
MEF = Ксантуренска Киселина
У веома мобилни мицрогаметес ће тражити и споји са мацрогамете. Унутар 12-24 сата резултујући зигот развија у оокинете. Оокинете је покретан инвазивна фаза која ће попречна оба перитропхиц матрицу и мидгут епител комараца. Трансверсинг тхе мидгут епител подразумева инвазију и излазак неколико епителне ћелије пре појављују на базалном страни епитела. Процес инвазија сличне на друга Апицомплека осим што оокинете нема рхоптриес и не формира параситопхороус Вацуоле након инвазије ћелију домаћина. (Погледајте детаље о механизму инвазије ћелија домаћина.)
Спорогони. Након достизања екстрацелуларни простор између епителних ћелија и базалне ламине је оокинете развија у ооцист. У ооцистама подвргнути асекуал репликације под називом спорогони, који кулминира у производњи неколико хиљада спорозоитес. Ово обично траје 10-28 дана у зависности од врсте и температуре. Након сазревања на ооцист руптуре и ослобађа спорозоитес које прелазе базалне ламине у хемоцоел (телесне шупљине) од комарца. (Видети животног циклуса фигура.)
Ове спорозоитес су покретан и имају способност да се специфично препознају пљувачних жлезда. Након проналажења пљувачних жлезда су спорозоитес покренути инвазију и попречна пљувачних жлезде епителне ћелије и доћи до леже у њеној лумена. Неке од ових спорозоитес ће бити избачен у кичмењака домаћина као комарац узима оброк крви, а тиме реинитиате инфекцију код кичмењака домаћина. Иако хемоцоел и пљувачне жлезде спорозоитес су морфолошки слични, они су функционално разликују. Пљувачне жлезде спорозоитес ефикасно нападне ћелије јетре, али не може поново нападну пљувачних жлезда, док су хемоцоел спорозоитес су неефикасни у инвазију ћелија јетре.
Укратко, паразита маларије показује животни циклус са типичним карактеристикама апицомплекан. Постоје три различита инвазивне фазе: спорозоит, мерозоите и оокинете. Све се одликују апексног органела и могу упасти или да прођу кроз ћелија домаћина. Два различита типа мерогони се посматрају. Први, назван екоеритхроцитиц сцхизогони, јавља у јетри и покреће спорозоит. Настали мерозоита онда напасти еритроците и пролазе кроз поновљене рунде мерогони зове еритроцитна сцхизогони. Неки од мерозоита произведених из еритроцитна сцхизогони ће проћи гамогони. Пласмодиум гамогони је описан у две фазе: гаметоцитогенесис које се појављују у крвотоку на кичмењака домаћина, а гаметогенезе одвија у комараца стомак. У гаметима споји да постане зигот који је први развија у оокинете, а затим постаје ооцист где спорогони одвија.
(За преглед животног циклуса у комарца видим Ла Батон-ЛЦ Ранфорд-Картрајт (2005) Ширење семе од милион убица Смрт:. Метаморфозе маларије у комарца. Трендс ин Параситологи 21, 573-580.
Клиничке манифестације
Патологије и клиничке манифестације повезане са маларијом готово искључиво због асексуалних еритроцитна сценске паразита. Ткива сцхизонтс и гаметоцитес изазвати мало, ако их има, патологије. Плазмодијум инфекција узрокује акутно фебрилну болест која је највише за своје периодичне грознице пароксизама које се појављују на било 48 или 72 часовним интервалима. Озбиљност напада зависи од врсте Пласмодиум, као ио другим околностима, као што је стање имунитета и општем здрављу и ухрањености инфициране појединца. Маларија је хронична болест која има тенденцију да рецидива или опет избити (види објашњење разлике) над месецима или чак годинама.
Најчешћи начин за добијање маларије је кроз природне пренос од комараца (види животни циклус). Маларије могу да се преносе преко трансфузије крви или дељење шприцева. Механички пренос инфициране крви ће резултирати у краћем периоду инкубације јер ће бити фаза јетре. Постоји повећан ризик од смртности са механички-преносе П. фалципарум. Недостатак сценског јетре инфекције такође искључује могућност релапса код П. вивак или П. овале инфекција. Конгенитална пренос је и документовано, али се верује да је релативно ретка упркос јакој инфекције постељице.
Екоеритхроцитиц сцхизогони анд препатент и инкубација
|
Симптоми маларије обично почињу да се појављују 10-15 дана након уједа зараженог комарца. Типичне препатент и инкубација Следећи спорозоит инокулацију варирати према врстама (табела). Препатент период се дефинише као време између спорозоит инокулације и појаве паразита у крви и представља трајања фазе јетре и број мерозоита произведених. Инкубација имају тенденцију да буду мало и дефинисани су као време између спорозоит инокулације и појаве симптома. Понекад инкубација може продужити за неколико месеци у П. вивак, П. овале и П. малариае. Сва четири врсте могу показивати неспецифичне симптоме продромал неколико дана пре првог Фебрил напада. Ови продромал симптоми су обично описује као “грипу” и укључују: главобоља, благу грозницу, болове у мишићима, анорексија, мучнина и замор. Симптоми обично у корелацији са повећањем броја паразита.
Ови продромал симптоми ће бити праћено фебрилним напада такође познате као маларијским пароксизама. Ови пароксизма ће излагати периодичности од 48 сати за П. вивак, П. овале и П. фалципарум, и од 72-сата периодичност за П. малариае. Првобитно периодичност ових парокимс може бити неправилног пошто легла на мерозоита различитих екоеритхроцитиц сцхизонтс синхронизовати. Ово се посебно односи на П. фалципарум који не могу испољавати различита пароксизама, али показују континуирани грозницу, свакодневних напада или нерегуларне нападе (нпр., 36-48 час периодичност). Пацијенти могу такође да испољавају спленомегалија, хепатомегалија (благи жутица), и хемолитичка анемија током периода у коме јавити маларије пароксизма.
Маларичном Парокисм (види табелу) обично ласт 4-8 сата и почиње са наглим појавом грознице у коме пацијент доживљава интензиван осећај хладноће упркос повишеној температури. Ово се често назива хладном фази и одликује снажно дрхтање. Одмах након ово хладно фазу је вруће фаза. Пацијент се осећа интензивну топлоту у пратњи јаке главобоље. Умор, вртоглавица, анорексија, бол у мишићима, а мучнина често ће бити повезан са топлом фази. Следећа период обилно знојење ће уследити и грозница ће почети да опада. Пацијент је исцрпљен и слаб и обично заспати. Након буђења пацијент обично осећа добро, осим што уморни, а не испољава симптоме до почетка наредне пароксизма.
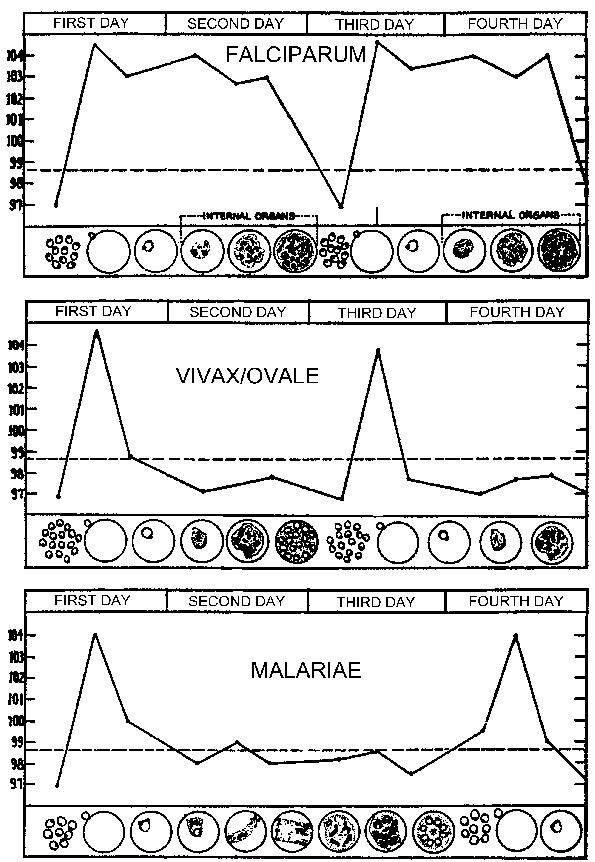

Периодичност ових пароксизама је због синхроног развоју маларичном паразита унутар људском организму. Другим речима, сви паразита унутар домаћина су на приближно истом фазе (тј ринг, тропхозоите, сцхизонт) као они настављају кроз сцхизогони. Маларичном Парокисм одговара руптуре заражених еритроцита и ослобађања мерозоита (Слика горе). 72 хоур Периодичност у П. малариае је због споријег раста и сазревања током блоод-стаге сцхизогони. Студије у П. вивак су показали повезаност између куге и серуму ТНФ-а (фактор туморске некрозе-алфа) нивоа (Слика десно). Претпоставља антигени или токсини се ослобађају када инфициране еритроцита руптуре и довести до производње ТНФ-а и фебрилним напада.
Озбиљност пароксизама и трајање симптома зависи од врсте (види Табелу у наставку). Уопштено, озбиљност болести корелира са просечне и максималне паразитемије испољава разних врста. П. фалципарум је у стању да произведе озбиљан и смртоносне инфекције, док су остале врсте су ретко смртни. Пацијенти инфицирани П. вивак, посебно за први пут, може бити прилично болестан. Међутим, С. Вивак ретко изазива компликације или резултате у смрт. Он приликом севере малариа укључујући мултипле органе такође је наведено у П. вивак инфекција (види Коцхар ет ал, Еид 11 (1), јануар 2005). Рецидива до активације П. вивак хипнозоитес може доћи из неколико година. С. овал је највише бенигни у да пароксизма имају тенденцију да буду благи и краткотрајне и рецидиви ретко јављају више од годину дана након иницијалне инфекције. П. малариае генерално производи благо обољење, али иницијална пароксизма може бити умјерено до озбиљног. То је највише хронична, иако, и рецрудесценцес су документовани неколико деценија након иницијалне инфекције. Овај хроницитет се понекад повезана са реналних компликација, које су вероватно због таложења антиген-антитело комплекса у гломерула бубрега. Маларичном пароксизма постаће мање сурови и неправилног периодичност као домаћин развија имунитет. Овај имунитет, међутим, није стерилизација имунитет што је инфекција потраје дуже од симптома и појединаца могу показивати релапса или рецрудесценцес или постану поново инфицирати. Уколико се не лечи, сви облици маларије имају тенденцију да буду хронични.
| Болест озбильность и траjанье | |||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|||||||||||||||||||||||||||||||||||||||||||||
За разлику од осталих три врсте, П. фалципарум може произвести озбиљне болести са смртним последицама. Ова повећана морбидитет и морталитет је делом због високим параситемиас повезаних са П. фалципарум инфекцијама. Ови потенцијално високе параситемиас доспевају делом и великим бројем мерозоита произведених и способности П. фалципарум да нападне све еритроците. Насупрот томе, П. вивак и П. овале преферирају ретикулоцитима (тј, незрели еритроцити), док П. малариае преферира Старости еритроцита (види разлике специес). Паразитемију може такође брзо повећати због цитоадхеренце и заплену П. фалципарум. Овај заплена у ткивима минимализује уклањање заражених еритроцита слезини и омогућава ефикаснију еритроцита инвазије .. Висока паразитемије и заплена резултирају других компликација повезаних са фалципарум маларије, што се првенствено односи анемије и церебрална маларија (објашњено у следећем поглављу ). Анемију је делом због уништења еритроцита током крви стадијуму сцхизогони. Штавише, нон-заражене еритроцити се уништавају на вишим стопама током инфекције и постоји смањена производња еритроцита.
Повећана морбидитет и морталитет фалципарум маларије
- све еритроцити инвазију
- Велики # на мерозоита
- конфискација
- имун избегавање
- компликације
Патогенеза и тешког облика маларије
Патхологи повезан са свим маларијским врста је везана за руптуре оболелих еритроцита и ослобађања паразита материјала и метаболите, хемозоин (тј маларија пигмента) и ћелијске остатке. Поред пароксизама разматраних горе, одлагање хемозоин одавно позната као карактеристична маларије. Постоји повећана активност ретикулоендотелног система, нарочито у јетри и слезини и отуда њиховог проширења, што доказује макрофаги са прогута заражених и нормалних еритроцита и хемозоин. Осим П. фалципарум, патологија повезан са маларије има тенденцију да буде бенигни. Неколико озбиљних компликација може бити повезана са фалципарум маларије уз церебралну маларију што највише и чест узрок деатх.Церебрал маларија одликује поремећеном свести (Бок).
Симптоми представљање су јака главобоља праћена поспаности, конфузија и коначно кома. Грчеви су такође често повезана са церебралном маларије. Ове неуролошке манифестације се верује да је последица заплену заражених еритроцита у церебралном малих крвних судова. Заплена се односи на цитоадхеренце од тропхозоите- и сцхизонт-инфициране еритроцита у ендотелне ћелије дубоких васкуларних кревета у виталним органима, нарочито мозга, плућа, црева, срце и плаценте. Ова заплена нуди неколико предности за паразита. Највећа предност је избегавање слезине и каснија елиминација инфицираних еритроцита. Поред тога, са ниским садржајем кисеоника напетости у дубоким ткивима може да обезбеди бољу метаболичку средину.
Церебрална маларија
- компликација тешке фалципарум маларије
- дифузни енцефалопатија са губитком свести
- свест креће од ступор до коме
- почетак може бити постепен или брзо
- реагују на бол, визуелни и вербални стимуланс
- повезане са заплене код церебралне микроваскулатури
Цитоадхеренце изгледа да посредована елеетронденсе избочина на површини заражене еритроцита. Ове “кнобс” су изражени током тропхозоите и сцхизонт фазама и настају као резултат паразитских протеина извезене у еритроцита мембрану. Међу људским Пласмодиум врсте, потенциометри су ограничене на П. фалципарум и тако наговештавају да дугмад играју улогу у цитоадхеренце. Поред тога, постоји и добра корелација између животињских Пласмодиум врста које изражавају Кваке и доказни заплену. Електронска микроскопија такође показује да су дугмад су додирне тачке између зараженог еритроцита и ендотелне ћелије.
- изложени на површини инфицираних еритроцита
- везује за потенцијалних рецептора домаћина
- члан вар породице гена
Он молекуларни механизми цитоадхеренце укључују интеракције рецептор-лиганд. Другим речима, протеини експримирани на површини заражене еритроцита (лиганд) ће се везати за протеине експримиран на површини ендотелних ћелија (рецептор). ПфЕМП-1 (еритроцитног мембранског протеина) је паразит протеин који је имплициран као цитоадхеренце лиганд (Бок). У Контраст на Обично веома конзервирани природе интеракција рецептор-лиганд, ПфЕМП-1 је члан изузетно променљиве (= вар) гена породице са 40-50 различитих гена. Неколико домаћини протеини који евентуално функционишу као рецептори су идентификовани (види оквир испод). Многи од ових домаћина протеина функционисати интеракције ћелија-ћелија и учествују у ћелијском адхезију. Неколико студија је показала да су експресија различитих ПфЕМП-1 гена у корелацији са различитим фенотипа везивање за рецептор. Ова антигени варијација повезан са површином изложен ПфЕМП-1 омогућава паразита да избегне имуни систем. Међутим, функција цитоадхеренце очувана кроз своју способност да препозна више рецепторе (Слика). Ово антигени варијација такође може објаснити различите исходе болести. На пример, интрацелуларни адхезиони молекул-1 (ИЦАМ-1) се обично имплициран у церебрал патологији.
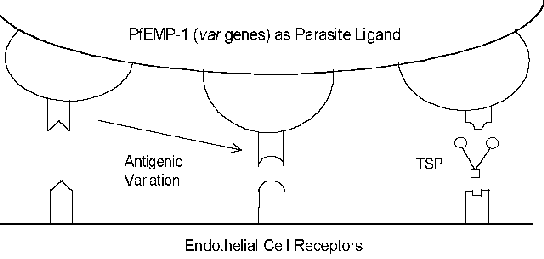
Могући рецептори
- CD36
- Ig Super-family
- ICAM-1
- VCAM-1
- PE-CAM-1
- E-selectin
- thrombospondin (TSP)
- chondroitin sulfate A
- Rosetting Receptors
- CR-1
- glycosaminoglycan
Рани запажања из патологије церебралне маларије предложио везу између великог броја заражених еритроцита у малих крвних судова и развоја синдрома. Првобитно претпостављено је да ће цитоадхеренце довело до механичког блокаде (тј церебрална исхемија) и накнадно хипоксију. Поред тога, паразит може такође изазвати локализоване метаболичке ефекте попут хипогликемије и / или млечна ацидоза. У хипоксија и метаболичке ефекте би онда изазвати кому и касније смрт. Међутим, постоје неки проблеми са хипотезом заплену:
- Кома повезан са церебрална маларија је брзо реверзибилна након третмана,
- висок проценат преживелих нема перманант неуролошких компликација,
- недостатак исхемијских оштећења (искључио хипоксије као главни механизам),
- заплена се јавља у не-церебрална маларија.
Неуролошка последице међу жртвама је церебрална маларија:
23.3% на отпусту
8,6% у једном месецу
4,4% на шест месеци
van Hansbroek (1997) J. Ped. 131:125
Због ових проблема су други сугерисали да се кома посредован кратког века молекула који утичу церебралну функцију. Могући медијатори домаћини укључују цитокине, као што су ТНФ-а или азот оксида. У овој теорији цитокина, маларијским антигени ће стимулисати ТНФ-а која онда може да доведе азот оксида или имају друге патолошке ефекте. Азот оксид Познато је да утиче неурона функције, а такође може довести до интракранијалне хипертензије преко свог вазодилататорског активности. Мало је вероватно, међутим, да би системски ослобађање цитокина изазове кому и потребно је такође претпоставити да је ослобађање ових медијатора у мозгу би довело до високим локалним концентрацијама. Поред тога, постоји минимална лимфоцита инфилтрација или упала повезаних са блокираним капилара.
Хипотеза Секвестрација и теорија цитокина за патофизиологијом церебрална маларија нису међусобно искључиви, и оба феномен вероватно да се укључе. На пример, паразита егзо-антигени, које се ослобађају у еритроцита руптуре, Познато је да стимулишу макрофаге да луче ТНФ-а. ТНФ-а Познато је да позитивно регулишу експресију адхезионих молекула попут ИЦАМ-1 на површини мозга ендотелних ћелија. То би довело до повећала везивање заражених еритроцита и појачавају ефекте ли су услед васкуларне блокаде, растворљиве посредника, метаболичких ефеката или комбинације (Фигуре).
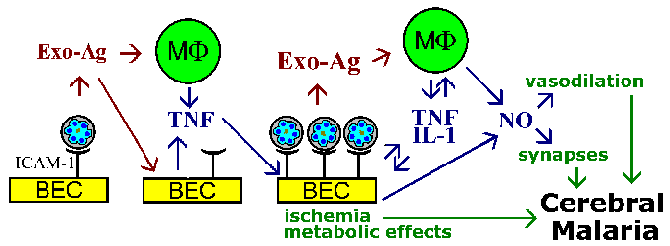
Шематски модел који описује неке од могућих посредника церебралне маларије. Цитоадхеренце инфицираних еритроцита у мозак ендотелних ћелија (БЕЦ) и ослобађање егзо-антигена може стимулисати БЕЦ и имуне ефекторске ћелије су а макрофага (МФ) да лучи цитокине. Ови цитокини, као што фактор некрозе тумора-а (ТНФ), би довело до повећане експресије могућих рецептора ендотелијалних ћелија (нпр., ИЦАМ-1) и промовишу повећање цитоадхеренце заражених еритроцита. Велики број везаних инфицираних еритроцита могло довести до васкуларне блокаде и хипоксију и да локализован метаболичке ефекте (нпр., Хипогликемија, млечна ацидоза). Повећан број заражених еритроцита и егзо-антигенима, такође доводи до виших нивоа цитокина. ТНФ-а је такође познато да стимулише азот оксид (НО). Нитриц окиде може да утиче на неуронске функцију омета неуротрансмисију. Нитриц окиде такође изазива вазодилатацију која може довести до интракранијалног хипертензије повезане са церебрална маларија. Фигуре прилагођено из Паслоске и Ховард (Анну Рев Мед 45:.. 283, 1994).
Укратко:
- П. фалципарум може изазвати озбиљне и фаталну болест
- то је повећало патхогенецити у поређењу са другим људским маларије се односи на П. фалципарум ‘с:
– висок репродуктивни капацитет
– цитоадхеренце и заплена - заплена доприноси вишој репродуктивне способности преко избегавање слезине
- цитоадхеренце за ендотелијалне ћелије такође могао локални патолошке ефекте а посебно је вероватно укључен у церебрална маларија
- Патофизиологија церебрална маларија није у потпуности схваћен, али вероватно подразумева вишеструке факторе и сложене интеракције између домаћина и паразита
Ревиевс он тешког облика маларије и патогенезе:
- IA Clark, WB Cowden (2003) The pathophysiology of falciparum malaria. Pharmacology & Therapeutics 99, 221-260.
- R Idro, NE Jenkins, CRJC Newton (2005) Pathogenesis, clinical features, and neurological outcome of cerebral malaria. The Lancet Neurology 4, 827-840.
- CL Mackintosh, JG Beeson, K Marsh (2004) Clinical features and pathogenesis of severe malaria. Trends in Parasitology 20, 597-603.
- A Trampuz , M Jereb, I Muzlovic, RM Prabhu (2003) Clinical review: Severe malaria. Critical Care 7, 315-323.
Епидемиологија
Иди на одељак о:
Маларија је пре свега болест у тропским крајевима и субтропа и широко распрострањена у топлим влажним регионима Африке, Азије и Јужне и Централне Америке. Болест је такође уобичајено у многим умереним подручјима, укључујући САД, Европи и северној Евроазији и Азији, али је искорењена. У многим областима које су раније имале маларије под контролом доживљавају препород (види чланак у Тхе Атлантиц). Четири људска маларијским специес показују преклапа географску дистрибуцију (табела). С. Вивак и П. фалципарум су најчешћих врста са С. Вивак је најраспрострањенији географски. Микед инфекције су уобичајене у ендемске области. Молекуларне методе сугеришу да је П. малариае и П. овал могао бити широко распрострањена и преовладава да се раније мислило (види Муеллер ет ал, ТР Параситол 23:.. 278, 2007).
Географски Расподела |
||||||||
|---|---|---|---|---|---|---|---|---|
|
Епидемиологију маларије може посматрати у смислу буде стабилна (или ендемична) или нестабилна (или епидемија). Стабилна маларија односи се на ситуацију у којој постоји мерљиво учесталост природних преноса током неколико година. Ово би такође укључују области које доживљавају сезонски пренос. Различите области могу искусити различите нивое стопе инциденције и то је често означен: хипоендемиц, месоендемиц, хиперендемиц, и холоендемиц. Особе које живе у веома ендемске области обично показују висок ниво имунитета и толерисати инфекцију добро.
Маларија Епидемиологија
стабилна или ендемиц маларија
- претрпео инциденце током неколико година
- укључује сезонски пренос
- различити нивои ендемичности
- имунитет и толеранције болести корелира са ендемичности
- епидемија невероватне
нестабилна или епидемија маларије
- приметан пораст учесталости
- популација је нон-имуна
- морбидитет и морталитет могу бити високи
Нестабилне, односно епидемија, маларија односи се на повећање маларије у областима ниске ендемичности или појаве у областима раније без маларије или код не-имуне особе. Ове епидемија се обично приписује промене у људском понашању или утицаја на животну средину. На пример, хумани миграције и расељавања могу или увести маларију у област или приказали претходно неимуној популацији у ендемске преноса. Промене у екологији изазваних природним непогодама или јавних радова, као што су изградња путева може утицати маларије пренос и довести до епидемије.
“Све у вези са маларијом је тако обликовао локалним условима да постане хиљаду епидемиолошке загонетке.”
Хекет (1937)
Наведени цитат наглашава сложеност маларије и многим аспектима експоната болести. Различите заједнице ће искусити другачији маларије и самим тим различите стратегије контроле и третман може бити неопходно. Густој Интеракције између домаћина, паразит и вектора су главни фактори у овом епидемиолошког сложености.
На пример, као и код свих вектора преносивих болести, паразита мора бити у стању да успостави хроничну инфекцију у домаћину да би се максимално могућности за пренос. Ово је посебно тачно у случају сезонског преноса и у областима ниске ендемичности. И уопштено маларије инфекција одликује иницијалне акутне фазе следи дужи релативно асимптоматске хроничној фази. То је делом због способности паразита се избегла потпуну клиренс имуни систем. На пример, П. фалципарум показује антигену варијанту којом омогућава да остану један корак испред имуног система. Поред тога, П. вивак и П. овале показују хипнозоите фазу и способни рецидива. Ово омогућава паразита да задржи инфекцију унутар људског домаћина и након фаза крв инфекције је обрисана. Релативна дужи интервал између рецидива у неким П. вивак изолује вероватно објашњава своју способност да одржи циклуса преноса у неким умереним климатским условима.
Неколико студија Молекуларна епидемиологија су показале да П. фалципарум такође може произвести дугорочне хроничне инфекције (видети Ропер ет ал доле).
| Ропер ет ал (1996) АЈТМХ 54: 325
Студија сајт = источни Судану (месоендемиц, сезонски пренос) |
|
||||||||||||||||||||||||
Што се тиче домаћина, људи су једини значајни резервоар за паразита и одржава пренос зависи одржавање пул инфицираних појединаца и контакта између људи и анопхелине комараца. Неколико фактора утичу на осетљивост људи на инфекцију. Очигледно је да је имуни статус појединца и њихово претходно искуство од маларије ће утицати на ток инфекције. Труднице, посебно током прве трудноће, су више подложни фалципарум маларије као што је илустровано већим распрострањености инфекције и виших параситемиас. Поред тога, одређене генетске болести и полиморфизама су повезани са смањењем инфекције или болести (види природне отпорности).
Потенцијал комарца да служе као вектор зависи од способности да подржи спорогони, Комарац обиље и контакт са људима, који су сви под утицајем климатских и еколошких фактора (табела). Способност да подрже спорогони углавном зависи врсте у томе нису све врсте Анопхелес су подложни Пласмодиум инфекције. Температура и комараца дуготрајност су други кључни фактори утичу интеракције на паразита са вектором. Развој П. фалципарум захтева минималну температуру од 20оЦ, док је минимална температура за друге врсте је 16оЦ. Температуре такође утиче на време развоја да трајање спорогони суштински краћа при вишим температурама. Краћи трајање спорогони повећава шансе да ће комарац преносе инфекцију унутар свог животног века.
Фактори који утичу на вецториал Капацитет
Спорогони
- комарац Густина
- людски Контакт
- температура
Комарац дуговечност
- комараца врста
- температура
- висина
- падавине
Узгој места
- антхропопхилиц
- затворени вс отвореном
- време храњења
Густина комараца и навике у исхрани и утичу на пренос маларије. густина комараца зависи од температуре, надморске висине, падавина и расположивости приплодних места, док је људско-комараца контакт ће бити под утицајем понашања комараца. На пример, степен у којем се посебно комараца врста је антхропопхилиц утицати вероватноћа комарца заразе, а затим преношења инфекције другом човеку. Ове антхропопхилиц тенденције морају апсолутно у исто толико зоопхилиц комарци ће се пребацити на људе ако густина достићи висок ниво или пожељан извор животиња се смањује. Пожељна време храњења и да ли је комарац храни претежно затвореном или отвореном простору ће утицати динамика преноса. На пример, на отвореном исхрану комарци имају веће шансе да нађу храну људске крви у раним вечерњим сатима у односу на оне храњење касно ноћу када је већина људи унутра. Понашање комарца такође треба узети у обзир контролних активности.
“Парадоксално, ризици тешког обољења у детињству били су најнижи међу популацијама са највишим преноса интензитета, а примећено између популација изложених ниским до средњим интензитетом преноса највише ризика болести.”
Снов ет ал (1997) Ланцет 349: 1650
Имунитет
Особе које живе у ендемским подручјима до развије имунитет против маларије. Скоро увек особа ће излагати симптоме током почетних изложености маларије. Симптоми повезани са каснијим изложености маларије су обично мање озбиљна, мада. Имунитет против маларије споро развија и захтева више експозиција. У веома ендемских подручја само мала деца су у високом ризику од развијања озбиљне фалципарум маларије док старија деца и одрасли су у основи заштићени од тешке болести и смрти. Међутим, овај имунитет није стерилизација имунитет у којима ће лица и даље могу да се заразе. Поред тога имунитет краткотрајно иу одсуству поновног излагања ниво имунитета опада. На пример, раније полу-имуни одрасли често развију озбиљне маларије по повратку у ендемске области након што је у неендемским простора за 1-2 година. Ово стање делимичне имунитета у коме паразитемије је спуштена, иако се не елиминишу, а паразитемије боље толерише (слика) се понекад назива премунитион. Премунитион се односи на имунитет који је зависан патоген присуства.
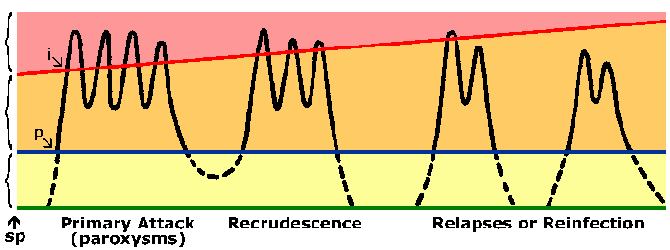
Дијаграм представља ток инфекције маларијом. Црна линија приказује крвни стаге паразитемију следеће спорозоит инфекције (сп). Постоји препатент период (п) измедју спорозоит инокулације и детекцију паразита у крви. Плава линија приказује микроскопска праг (нпр, лимит детекције) и жута област представља субпатент паразитемију. Наранџаста област представља симптома, патент паразитемију. Црвена линија приказује клиничке праг или паразитемију која производи пароксизама или других клиничких симптома (пинк Област). Као имунитета развија овог клиничког прага повећава. Период инкубације (и) је време између инфекције и појаве симптома.
Имуни одговор може бити усмјерен на било претприступних еритроцитна или еритроцитна фазама паразита животног циклуса. Међутим, еритроцитна фаза животног циклуса је вероватно најважнији у смислу чишћења паразита и ублажавање болести. Због недостатка ХЛА молекула на површини паразита или еритроцита је обично претпоставља да ће антитело играти кључну улогу у крви стадијуму имунитет. Могући ефекторне механизми за антитело обухватају: блоцкинг еритроцита инвазију мерозоита, антитела зависну ћелијску убијање посредованих цитопхилиц антитела, или повећану клиренс заражених еритроцита због везивања антитела за паразитски антигени изложене на еритроцита површини. Све ово ће резултирати у доњем паразитемије. Релативни значај ових различитих механизама није јасан и вероватно имунитет вероватно захтева стварање антитела против бројних циљева. Ово, заједно са антигенски варијације и полиморфизма у многим Пласмодиум антигена, може да објасни спори развој имунитета.
Примедба да асимптоматски појединци могу показивати високе нивое паразитемије довела до концепта “имунитета против болести”. То би било поред ‘анти-паразитске “имунитет горе разматрано које резултира нижим параситемиас. Севере маларије и смрт су у корелацији са ТНФ-а и других проинфламаторних цитокина. Као што је разматрано за паракоисмс и церебрална маларија, антигени или токсини ослобађају зараженог еритроцита може стимулишу продукцију проинфламаторних цитокина. Антитела против ових егзо-антигени би могао неутралисати своје токсичне ефекте и довести до имунитету анти-болести.
Разматра о имунитету на Малариа:
Ј. Лангхорне ФМ Ндунгу, ПМ Спонаас, к Марш (2008) Отпорност на маларију: више питања него одговора. Природа имунологију 9, 725 – 732.
Због тешкоћа у контроли маларије другим средствима постоји велико интересовање за развој вакцине против маларије. Тренутно нема доступне вакцине, али постоји значајан истраживачки напор усмјерен идентификовања кандидата за вакцину и тестирање потенцијалних вакцина за безбедност и ефикасност. Комплекс животни циклус и биологија паразита дају неколико потенцијалних циљева (табела 15.9). На пример, вакцинација против спорозоит или екоеритхроцитиц фази могла да спречи инфекцију. Међутим, индукована имунитет би морао бити потпуно ефикасна јер би бекство једног спорозоит довести до крви стадијуму инфекције и болести. Вакцине усмерено против мерозоита или инфициране еритроцит би смањити паразитемију путем ометања мерозоите инвазији или повећање елиминацију заражених еритроцита. Таква вакцина би потенцијално могла ублажити велики део патогенезе повезан са маларије, чак и ако то није заврши на снази. Поред тога, инфекција може да послужи да појача имуни одговор. Могуће вакцинисати против болести имунизацијом против потенцијално токсичних антигена. Антитела неутрализацију антигене који стимулише проинфламаторних имуни одговор може умањити неке од патогенезе повезане са маларијом. Сексуални фазе паразита као што су гаметоцитес и полних ћелија такође може бити мета. Антитела усмерена против гамета антигена може спречити инфекцију комарца и спорогони. Таква вакцина би била алтруиста у томе да не би заштити појединца од болести, али штите друге у заједници спуштањем пренос.
Потенцијал Вакцина Стратегије
Механизам Циљ Заштита
спорозоит анти-инфекција превенције или елиминације фазу јетре
мерозоите анти-паразита смањење ефикасности мерозоите инвазије
инфецтед РБЦ анти-парасите повећање клиренс заражених еритроцита
екоантигенс нижи анти-болест продукцију инфламаторних цитокина
сексуалне фазе анти-пренос елиминише гамете или спречи инфекцију
Људска генетика и природне отпорности
Урођена отпорност
- Дуффи-негативне
- овалцитосис
- српастих ћелија анемија
- Тхалассемиа
- G6PD недостатак
Одређене генетске болести и полиморфизама су повезани са смањењем инфекције или болести (Бок). На пример, појединци који немају Дуффи крвни група антигена су отпорни на П. вивак. Велики део становништва у западној Африци су Дафи негативан, што чини ниским нивоима П. вивак у западној Африци. Ова урођена отпор довело до идентификације Дуффи антигена као еритроцита рецептор за мерозоите инвазију. (Видети интеракције рецептор-лиганд током мерозоите инвазије.)
Неколико поремећаји наслеђени еритроцита се налазе углавном у маларије ендемске области и на фреквенцијама знатно већим него што се очекивало. То је довело до спекулација да су ови поремећаји преносе неку заштиту од маларије. На пример, југоисточно азијски овалцитосис је због мутације у једном еритроцита мембране протеин бенд 3. Ова мутација доводи до еритроцита мембрану да постану круте и отпорне на мерозоите инвазију. Механизам (е) којим другим болестима могу обезбеђује заштиту од маларије нису познати. У већини случајева се претпоставља или спекулише да комбинација дефекта и инфекција доводи до превременог лизе и одобрења инфициране еритроцита. На пример, глукоза-6-фосфат дехидрогеназа (Г6ПД) дефицитарни еритроцити би имао ослабљени способност да рукује оксидативни стрес (видети наркотике актива). Додатни оксиданти произведени као резултат паразита метаболизма и варења хемоглобина (види биоцхемистри Нотес) могла да превлада зараженог еритроцита и доводе до њеног уништења пре паразит може да заврши сцхизогони. Анемија српастих ћелија, а таласемија такође спекулисало да би заразио еритроцит подложније оксидативног стреса.
Огляд он црвених крвних полиморфизма и маларије:
- G Min-Oo, P Gros (2005) Erythrocyte variants and the nature of their malaria protective effect. Cellular Microbiology 7, 753-763.
- TN Williams (2006) Human red blood cell polymorphisms and malaria. Current Opinion in Microbiology 9, 388-394.
- TN Williams (2006) Red blood cell defects and malaria. Molecular and Biochemical Parasitology 149, 121-127.
Маларије у Америка
Маларија је претходно више распрострањена у умереним областима, укључујући Северној Америци и Европи. Сматра се да је маларија уведен у Америку од стране европских колониста (П. вивак, П. малариае) и афричких робова (П. фалципарум) током 16. и 17. века. Маларија је постала ендемска у многим деловима САД осим пустиње и планинских подручја и учесталости вероватно достигла врхунац око 1875. Прелаз становништва из руралних у урбана подручја, одводњавање мочвара да створи пољопривредно земљиште, побољшану становање и исхрану, боље социо-економских услова и стандарда дневна, већи приступ здравственим услугама, и доступност кинин за третман допринео паду у распрострањености маларије и пре увођења посебних мера контроле (бок). Неке контролне активности, као што су откривање случаја и лечење, ларвицидинг и кућа прскање, уведени су током 1940-их и довели до искорењивања маларије у Сједињеним Америчким Државама. Од 1950-их су увезени скоро сви случајеви маларије у САД. Главни фактори који доприносе овом сузбијању изгледа да померање становништва из руралних у урбана подручја и повећање животног стандарда, што је резултирало побољшањем становање, бољу исхрану и бољи приступ медицинским услугама.
Фактори који доводе до пада у преносу маларије у Америка
- померање становништва из руралних у урбана подручја
- побољшани социоекономски услови
- одводњавање размножавања
- доступност кинин
- контроле комараца активности
Велика већина маларије случајева дијагностикованих у Сједињеним Америчким Државама стичу особе, док путују у земље у којима је маларија ендемска. Међутим, током 1990-их било је неколико избијања аутохтоне преноса маларије у САД (Зуцкер, 1996). Ове епидемије су повезане са густо насељеним подручјима и великог броја имиграната. Више од 80% случајева били П. вивак. Поред тога, епидемије су повезане са необично топлом и влажном времену, што може повећати анопхелине преживљавање и смањила трајања спорогониц циклуса, омогућавајући за развој инфективних спорозоитес. (Видети такође недавни извештај о седам случајева локално стечене П. вивак маларије која се догодила у Флориди током јула и августа 2003. године, ММВР 52:. 908)
Смање људски-комараца контакт
- импрегнирани беднетс
- репеленти, заштитна одећа
- екрани, кућа прскање
смањити вецтор густине
- модификација животне средине
- ларвицидес / инсектициди
- биолошка контрола
смањити паразита резервоар
- откривањем и лечењем цасе
- хемопрофилакса
Превенција и контрола
Стратегија за превенцију и контролу маларије укључују три различита приступа (види оквир). Превенција маларије код појединаца генерално укључивати смањење људски комараца контакта кроз употребу беднетс, репеленти, итд Хемиопрофилакса (види доле) се такође могу користити, нарочито у путнике. Међутим хемопрофилакса само потискује паразитемију и не спречава инфекцију.
Контролне активности на нивоу заједнице могу да користе приступе који се директно смањују људско-комараца контакт, као и приступа који смањују укупан број комараца у подручју. Такви приступи укључују смањење комараца размножавања (нпр еколошка модификација), циљати фаза ларве са хемијским или биолошким агенсима и масивном прскање инсектицидима за одрасле комараца. Биолошке методе контроле укључују увођење рибе која једу ларве комараца или бактерије (нпр Бациллус тхурингиенсис) која излучују ларве токсине. откривањем и лечењем случај је још један потенцијални метод контроле. Откривању и лечењу заражених особа, посебно асимптоматских индивидуа ће смањити величину паразитске резервоара у људској популацији и може да смањи цене преноса. Међутим, ово може да буде релативно скуп приступ.
Ови приступи нису узајамно искључиве и могу да се комбинују. Многи од успешних програма контроле укључују и мере за контролу комараца и лечење инфицираних особа. Не постоји стандардни метод контроле маларије који се показао универзално делотворна. Епидемиолошке, социоекономске, културне и инфраструктурни фактори одређеног региона ће одредити најприкладнији контрола маларије. Неки од фактора који треба узети у обзир укључују:
- инфраструктура постојећих здравствених услуга и других извора
- интензитет и периодичност (нпр сезоналност) преноса
- москуито врсте (еколошки захтеви, карактеристике понашања, инсектицид осетљивост, итд)
- паразита врсте и осетљивости дроге
- културне и социјалне карактеристике становништва
- Присуство друштвене и еколошке промене
Контрола маларије у тропске Африке је посебно проблематично због високе стопе преноса и укупном ниског социо-економском нивоу. Неколико студија је показало да инсектицид третира беднетс (ИТБН) смањи морбидитет и морталитет повезане са маларијом. У већини области увођење беднетс не захтевају велике промотивне програме и њихова употреба је спремно прихватили. То може да буде делимично због смањења комараца неприлика гризе. Нека питања су подигнуте у погледу економске одрживости беднет програма. Неопходно је да се поново третира беднетс са инсектицид повремено и беднетс треба да се поправи и замени чим постану цепање и истрошити. Поред тога, неки су изазвали су забринутост у вези са дугорочним предностима беднетс јер смањују изложеност, али не елиминишу. Ово смањење изложености може да одложи стицање имунитета и једноставно поспоне морбидитета и морталитета у старијим старосним групама.
[Коментар о контроли маларије: Р.С. Филипс (2001) Тренутни статус маларије и потенцијала за контролу. Мед. Мицробиол. Откривење 14: 208].
Дијагноза
- Историја је у ендемског области
- симптоми: грозница, дрхтавица, главобоља, малаксалост
- спленомегалија, анемија
- микроскопска демонстрација паразита (блоод смеар)
- детекција антигена (нпр., БинакНОВ Малариа, Парасигхт-Ф, Оптимал)
- ПЦР амплификација паразита ДНК
Маларија је осумњичен за особе са историјом је у ендемске области и представљање симптома у складу са маларије (види клиничким манифестацијама). Ови симптоми, нарочито у раним фазама инфекције, неспецифични и често описују као грипу. Како болест напредује, пацијент може испољити увећану слезину и / или јетре и анемију. Дијагноза се потврђује микроскопом. Густом крвљу размази су генерално осетљиви за детекцију паразита, док танке размази су пожељни за идентификацију врста. (Видети крв-стаге морфологију Пласмодиум врста.) Уколико паразити нису нађене на првом крвљу брис препоручује уложити додатне брисева сваких 6-12 сата докле 48 сати. Одредницама Дијагноза П. фалципарум (бројни и искључиво прстена фазама) може представљати медицинску хитност, посебно у неимуној особа. Рапид иммуноцхроматограпхиц тестови (тј мерни штапови) на основу детекције антигена су доступни (види преглед).
Хемотерапија и дрога Отпор
Неколико Антималаријски лекови су доступни. Многи фактори су укључени у доношење одлука најбољи третман за маларије. Ови фактори обухватају паразита врсте, озбиљности обољења (нпр., Компликоване), старост пацијента и имуни статус, подложност на паразита до лекова (тј резистенције на лекове), а трошкове и доступност лекова. Стога, тачне препоруке често варира у зависности од географског подручја. Поред тога, различити лекови делују различито на различитим фазама животног циклуса (табела). Остали линкови интересовања:
- Механизми за здравље акције и отпора
- Виртуелни Морнарица болница, информације о лечене и анти-мигрене
- СЗО, за на анти-малалариал коришћења
- Медицински Писмо чланак о дрогама за паразитских инфекција
Изабрани Антималаријски Лекови
|
Брзоделујући крви сцхизонтоцидес, које делују на позорници крви паразита, се користе за лечење акутних инфекција и брзо ублажавање клиничких симптома. Хлорокин је генерално препоручује третман код пацијената са П. вивак, П. овале, П. малариае и некомпликованим Хлорокин осетљиви П. фалципарум инфекција. Хлорокин је безбедан и обично добро подноси. Споредни ефекти могу укључивати свраб (тј, свраб), мучнину или узнемирености. Пацијенти инфицирани или П. вивак или П. овале, и које нису под високим ризиком за реинфицирање, треба третирати са примаквином (а сцхизонтоциде ткива). Примахин је ефикасан против фази јетре паразита, укључујући хипнозоитес (види рецидива), те ће спречити будуће рецидива. Комбинација хлорокин и примаквином се често назива “радикални лек”.
Тешка, или компликован, фалципарум маларије је озбиљна болест са високом стопом смртности и мора се сматрати опасне по живот, а тиме и захтева хитно лечење. Третман типично захтева парентералну примену лека (тј, ињекција) пошто пацијенти су често коми или повраћање и стога не могу узети лекове орално. Парентерални формулације су доступни за Хлорокин, кинин, Хинидин и Артемисинин деривата. Деривати Артемисинин су генерално преферирани избор, али се још није одобрен свуда. На пример, у Сједињеним Америчким Државама кинин и кинидином су одобрени лекови за тешке маларије. Пацијенти морају се континуирано пратити хематокрита, паразитемије, ниво хидратације, хипогликемија и знацима токсичности и других компликација током лечења. Прекидач за оралну примену треба да буде чим је пацијент у стању. Већина смртних случајева због тешког облика маларије јављају на или у близини куће у ситуацијама у којима се пацијенти не могу бити предузете у болницу. Артемисинин супозиторије које могу да се примене сеоских здравствених радника су развијени и доказали да буду безбедни и ефикасни.
Ефикасност хлорокин увелико смањена широким отпором спреад хлорхин П. фалципарум и појаве хлорхин резистентне П. вивак. Ако Хлорокин терапија није ефикасна, или ако је у области са хлорхин отпорно маларије, заједничке алтернативни третмани обухватају: мефлохин, кинин у комбинацији са доксициклин или Фансидар®. Деривати артемизинина (дихидроартемизинина артесуната и Артеметхер) се све више користи у Азији и Африци, а сада препоручују као прва линија третмана од стране Светске здравствене организације. Ови лекови су изворно потиче из пелен биљке (Артемесиа аннуа) и коришћени су за дуже време у Кини као биљни чај куинхаосу назива за лечење фебрилних болести. Да спрече високу стопу поновно избијање повезани са Артемисинин дериватима и да успоре развој резистенције на лекове препоручује да лечење може комбиновати са неповезана анти-маларичан. Лекови који се користе у комбинацији са артемисинина укључују мефлохин, лумефантрине, Фансидар® и амодиахин.
Хемиопрофилакса. Хемиопрофилакса је посебно важно за особе са не-маларичан подручја који посјећују подручја ендемичних за маларију. Такви не-имуне особе брзо могу развити озбиљан и опасна по живот болести. Као иу случају третмана не постоји стандардни препорука и избори за Хемиопрофилакса су веома зависи од услова у вези са путовањима и индивдуал особе. (Видети ЦДЦ Фацтсхеет о спречавању маларије.) Хемиопрофилакса захтева коришћење нетоксичних лекова јер ови лекови ће се узети током продуженог периода времена. Генерално пацијент ће почети да узме лек пре путовања, а онда настави да буде лек за време боравка у ендемске области и наставити узимања лека након повратка. Ово је да се осигура лек се одржава на довољним нивоима широм напоље посете и за заштиту од било ког инфекције добијене током посете. Нажалост, многи од ефикасних и нетоксичних лекова (нпр хлорохин, пириметамин, прокуанил) су ограниченог коришћења због резистенције на лекове. Друга стратегија заснива се на претпоставкама (или ‘стандби’) третман који се користе заједно са профилакси. У овом случају особа или форгоес профилаксу или предузима цхлорокуине или другог релативно нетоксичан лек за профилаксу и носи лек као што Фансидар, мефлохин или кинин, коју ће се ако почну да испољавају симптоме повезане са маларијом.
Употреба мефлохин за маларија Хемиопрофилакса је донекле контроверзна. Мефлохин ефикасна у превенцији маларије са једним ради недељно, пружајући предности лекове који треба да се администрирају дневно. На овом дози мефлохин толерише већина појединаца. Међутим, неки људи доживљавају неуропсихијатријских неповољно утиче, као што су поремећаји сна и ноћне море. Ово би могло да се погоршава међународна путовања која је стресан догађај. Рандомизирани, заслепљени и вођених суђења указују да неуропсихијатријских нежељене последице је само незнатно виши у мефлохин него са другим анти-мигрене.
Убијање екоеритхроцитиц фазу (тј, јетра) би спречила инфекцију крви и познат је као узрочних профилакса. Ово је веома пожељно у томе што ограничава количину времена треба да се узима пре него што профилактичко дрога и након путовања у ендемске области. Једини тренутно доступан лек за узрочно-профилакса је примахин. Међутим, маларија профилакса није одобрена употреба примаквином и требало би прописати само за профилаксу, од случаја до случаја. На пример, за особе које често имају путовања кратког трајања у високо ендемске области и да та особа не показује дехидрогеназа недостатак глукоза-6-фосфат. Тафеноквин је тренутно у процесу евалуације на терену за употребу у узрочних профилаксу.
У лечењу маларије:
- Pasvol G (2006) The treatment of complicated and severe malaria. Br Med Bull 75-76: 29-47.
- Newton P and White NJ (1999) Malaria: new developments in treatment and prevention. Annu Rev Med 50:179.
- White NJ (1996) The treatment of malaria. N Engl J Med 335:800.
- White NJ (2008) Qinghaosu (Artemisinin): The Price of Success. Science 320, 330-334.
Наркотике Отпор
отпорност на лекове, а посебно, отпор хлорохин је велики проблем јавног здравства у контроли маларије. отпорност на лекове је дефинисан неуспехом лечења и може се класификују у различите нивое зависно од временског оквира поновно избијање следећих третмана (Слика). Традиционално ова нивои резистенције су дефинисани као осетљиве (без поновно избијање), РИ (одложено поновно избијање), РИИ (еарли поновно избијање) и РИИИ (минимално или никакво анти-паразит ефекат). Модификовани Протокол заснован на клинички исход уведена од стране СЗО 1996. У овом протоколу ниво отпора изражена као адекватног клиничког одговора (АЦР), крајем неуспех лечења (ЛТФ), или почетком неуспех лечења (ЕТФ) као што је дефинисано на следећи начин :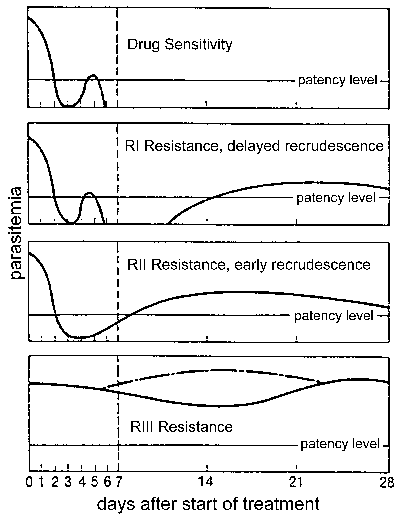
- АЦР, одсуство паразитемије (без обзира грознице) или одсуства клиничких симптома (без обзира на паразитемије) на дан 14. пранења
- ЛТФ, појављивање симптома или присуство паразитемије током дана 4-14 пранења
- ЕТФ, упорност клиничких симптома у присуству паразитемије током прва 3 дана пранења
Или протокол се може користити за одређивање отпорност на лек, али клинички исход протокол практичнији у подручјима интензивне преноса где може бити тешко разликовати поновну инфекцију од поновно избијање и где паразитемије у одсуству клиничких симптома је уобичајена. отпорност на лекове од стране било протоколом је одређена са ин виво тестовима у којима се пацијенти хоспитализовани и надгледаних током и наредним стандардни третман дрога. Постоје ин витро тестова који могу проценити ниво резистенције на лекове одређивањем ефикасност лекова против П. фалципарум гаје у култури (види Друг Ресистанце: маларије код СЗО). Ин виво и ин витро тестови не увек одговарају од имунитета домаћина и други фактори могу утицати на ин виво исходе. Идентификовање специфичних мутација која би могла бити повезана са отпором на лек (видети табелу на другу страну) такође може да доведе до развоја тестова базираних молекуларних маркера.
отпорност на лекове настаје када паразити са смањеном осетљивошћу на антималаријско лекови су изабрани под притиском дроге. У паду осетљивост лек може дати неколико механизама (видети Механизми Друг Ресистанце) и одражава генетску мутацију (е) или полиморфизам у паразитске популације. Лек ресистанце паразити имати селективну предност над паразите дрогом осетљиве у присуству лека и биће преференцијално преносити. Главни фактори у развоју резистенције на лекове су употреба субтерапијским доза лекова или не заврши начина лечења (табела). Нижим нивоима лекова ће елиминисати најосетљивија паразите, али они који могу да толеришу лек ће се опоравити и репродукују. Временом ће довести до даљег избор за паразите који могу да толеришу још веће дозе лека. Од суштинског је значаја да се одржи адекватну концентрацију лека за довољно времена да у потпуности елиминишу паразите из било ког појединца.
Фактори који доприносе развоју и ширење Друг Ресистанце
|
Хлорокин отпор. Након његовог увођења пред крај Другог светског рата, хлорохин убрзо постао лек избора за лечење и превенцију маларије. Не само да је Хлорокин ефикасан лек – вероватно због свог места дејства у вакуоли хране и њеног уплитања са формирањем хемозоин (види деловања лека) – али је релативно нетоксичан и јефтин. Две жиже хлорхин отпорне П. фалципарум су откривене у Колумбији и на граници Камбоџа-Тајланда током касних 1950-их. Током 1960-их и 1970-их, отпорне на паразите проширио по Јужној Америци, југоисточној Азији и Индији. Отпор је прво пријављено у источној Африци 1978. године и шире широм континента током 1980-их. Хлорокин отпоран С. Вивак није пријављено до 1989. године у Папуа Новој Гвинеји и сада наћи у неколико жаришта у југоисточној Азији и можда Јужној Америци.
Основа отпорности хлорхин се смањује Хлорокин акумулације у вакуоли хране паразита је. Даље, резистентност хлорохин могу делимично преокренути са инхибиторима П-гликопротеина (неког АБЦ транспортера), који су одговорни за резистенцију на више лекова (МДР) у туморским ћелијским линијама, што указује сличан феномен може јавити у Пласмодиум. Мутације у МДР налик гена из П. фалципарум (Пфмдр1) су умешани у отпору хлорхин. Међутим, ове мутације нису предиктивне отпора хлорхин у свим географским областима. ПфМДР1 Изгледа да допринесе степеном отпорности хлорхин, али сами није довољно да преноси резистенцију. Међутим, ПфМДР1 чини се да играју улогу у отпорности на мефлохин и халофантрин и утиче на осетљивост на артемисинина.
Други кандидат за хромозома отпора хлорхин идентификован кроз генетске крста и мапирање експеримента. А 400 кб регион на хромозому 7 је пронађен да се одвоји са отпором хлорхин и даље анализе предложио да један ген, назван Пфцрт, био одговоран за отпор хлорхин. Од укупно 10 полиморфизама идентификованих у овом гену, само појединачна мутација је перфецтедли повезан са фенотипом отпорности цхлорокуине. Ова мутација доводи лизина на остатку 76 се мења у треонин (К76Т). Неколико студија на терену показале повезаност између Пфцрт-К76Т и отпорност хлорхин коришћењем оба тестирања ин виво и ин витро методама. Она је недавно сугерисао да је било најмање 4 оснивач мутације у Пфцрт гена повезаних са различитим географским подручјима: Азија / Африка, Папуа Нова Гвинеја, Бразил / Перу и Колумбија (Вутон и сарадници, Натуре 418: 320, 2002) . Претпоставља употреба хлорокин резултирала затим селекције и ширење фенотипа отпорног.
Ревиевс он резистенције:
- Boland PB (2001) Drug resistance in malaria. WHO/CDS/CSR/DRS/2001.4
- Hyde JE (2007) Drug-resistant malaria — an insight. FEBS Journal 274, 4688-4698.
- Warhust D (2001) New developments: chloroquine-resistance in Plasmodium falciparum. Drug Resistance Updates 4:141.
- Wellems TE and Plowe CV (2001) Chloroquine-resistant malaria. J Inf Dis 184:770.
- Wongsrichanalai C, Pickard AL, Wernsdorfer WH and Meshnick SR (2002) Epidemiology of drug-resistant malaria. Lancet Infect Dis 2:209.
